VYEPTI 100 mg, solution à diluer pour perfusion, boîte de 1 flacon de 1 mL
Dernière révision : 12/09/2024
Taux de TVA : 2.1%
Laboratoire exploitant : LUNDBECK
VYEPTI est indiqué dans la prophylaxie de la migraine chez les adultes ayant au moins 4 jours de migraine par mois.
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique Liste des excipients.
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du médicament administré doivent être clairement enregistrés.
Patients souffrant de troubles cardiovasculaires, neurologiques ou psychiatriques
Les patients ayant des antécédents de maladie cardiovasculaire (par exemple, hypertension, cardiopathie ischémique) ont été exclus des études cliniques (voir rubrique Propriétés pharmacodynamiques). Aucune donnée de sécurité n'est disponible pour ces patients. Des données de sécurité limitées sont disponibles pour les patients présentant des facteurs de risque cardiovasculaire comme du diabète, des troubles circulatoires et une hyperlipidémie.
Les patients ayant des antécédents de troubles neurologiques ou les patients présentant un trouble psychiatrique non contrôlé et/ou non traité ont été exclus des études cliniques. Les données de sécurité disponibles pour ces patients sont limitées.
Hypersensibilité grave
Des réactions d'hypersensibilité grave, y compris des réactions anaphylactiques, ont été décrites et peuvent survenir dans les minutes suivant le début de la perfusion. Dans la plupart des cas, les réactions d'hypersensibilité se sont produites pendant la perfusion et n'étaient pas graves (voir rubrique Effets indésirables). En cas de survenue d'une réaction d'hypersensibilité grave, l'administration de VYEPTI doit être interrompue immédiatement et un traitement approprié doit être instauré. Si la réaction d'hypersensibilité n'est pas grave, la poursuite du traitement par VYEPTI est laissée à l'appréciation du prescripteur et doit tenir compte du rapport bénéfice/risque pour chaque patient.
Excipients
VYEPTI contient du sorbitol (E420). Les patients présentant une intolérance héréditaire au fructose (IHF) ne doivent pas recevoir ce médicament, sauf en cas de nécessité absolue.
L'historique détaillé des symptômes d'IHF doit être obtenu pour chaque patient avant de prescrire ce médicament.
Résumé du profil de sécurité
Plus de 2 000 patients ont été traités par VYEPTI lors des études cliniques. Parmi eux, environ 1 000 patients ont été traités pendant 48 semaines (quatre administrations).
Les effets indésirables les plus fréquents étaient une rhinopharyngite et une hypersensibilité. Dans la majorité des cas, les réactions d'hypersensibilité se sont produites pendant la perfusion et n'étaient pas graves. Quelques rares effets indésirables associés au site d'administration sont survenus dans des proportions comparables entre les patients recevant VYEPTI et ceux sous placebo (< 2 %), sans lien apparent avec le dosage de VYEPTI. L'effet indésirable lié au site d'administration le plus fréquent était une extravasation, qui est survenu chez < 1 % des patients recevant VYEPTI ou le placebo.
Liste tabulée des effets indésirables
Les effets indésirables observés lors des études cliniques et dans le cadre de la pharmacovigilance (tableau 1) sont présentés par classe de systèmes d'organes MedDRA et par fréquence. Les fréquences ont été définies selon la convention suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000).
Tableau 1 : Liste des effets indésirables
|
Classe de systèmes d'organes |
Effet indésirable (terme préférentiel) |
Catégorie de fréquence |
|
Infections et infestations |
Rhinopharyngite |
Fréquent |
|
Affections du système immunitaire |
Réactions d'hypersensibilité |
Fréquent |
|
Réaction anaphylactique1 |
Peu fréquent |
|
|
Troubles généraux et anomalies au site d'administration |
Réaction liée à la perfusion |
Fréquent |
|
Fatigue |
Fréquent |
1 Aucun cas n'a été rapporté lors des études PROMISE 1 et PROMISE 2, mais des cas ont été décrits dans d'autres études et post-commercialisation.
Description des effets indésirables sélectionnés
Rhinopharyngite
Lors des études PROMISE 1 et PROMISE 2, environ 8 % des patients recevant la dose de 300 mg, 6 % des patients recevant la dose de 100 mg et 6 % des patients sous placebo ont présenté une rhinopharyngite. La rhinopharyngite était plus fréquente après la première administration de VYEPTI quelle que soit la dose. L'incidence a diminué sensiblement avec les administrations suivantes et est restée relativement stable par la suite.
Réactions d'hypersensibilité et réactions liées à la perfusion
Des réactions d'hypersensibilité grave, y compris des réactions anaphylactiques, pouvant apparaître en quelques minutes après le début de la perfusion, ont été rapportées (voir rubrique Mises en garde spéciales et précautions d'emploi). Les réactions anaphylactiques décrites étaient associées à des symptômes d'hypotension et à des difficultés respiratoires et ont conduit à l'arrêt du traitement par VYEPTI. D'autres réactions d'hypersensibilité (notamment, angiœdème, urticaire, bouffées congestives, rash et prurit) ont été rapportées chez environ 4 % des patients recevant la dose de 300 mg, 3 % des patients recevant la dose de 100 mg et 1 % des patients sous placebo lors des études PROMISE 1 et PROMISE 2.
Les autres symptômes associés à la perfusion de l'eptinezumab ayant été rapportés incluent des symptômes respiratoires (congestion nasale, rhinorrhée, irritation de la gorge, toux, éternuements, dyspnée) et une fatigue (voir ci-après). La plupart de ces événements étaient non graves et transitoires.
Fatigue
Lors des études cliniques contrôlées contre placebo, environ 3 % des patients sous eptinezumab et 2 % des patients sous placebo ont ressenti une fatigue. La fatigue était plus fréquente le jour de la première perfusion. Après la première semaine et au cours des perfusions suivantes, la fatigue a été rapportée avec des incidences plus faibles comparables aux incidences observées avec le placebo.
Immunogénicité
Lors des études cliniques PROMISE 1 (jusqu'à 56 semaines) et PROMISE 2 (jusqu'à 32 semaines), l'incidence des anticorps anti-eptinezumab sur l'ensemble des deux études était de 18 % (105/579) et de 20 % (115/574) chez les patients recevant la dose de 100 mg et de 300 mg toutes les 12 semaines respectivement. Dans les deux études, l'incidence des anticorps anti-eptinezumab était maximale à la semaine 24, puis diminuait progressivement par la suite, même après les administrations suivantes toutes les 12 semaines. L'incidence des anticorps neutralisants sur l'ensemble des deux études étaient de 8,3 % (48/579) et de 6,1 % (35/574) dans les groupes de traitement à la dose de 100 mg et de 300 mg respectivement.
Lors d'une étude en ouvert, PREVAIL (jusqu'à 96 semaines de traitement par VYEPTI à la dose de 300 mg toutes les 12 semaines), 18 % des patients (23/128) ont développé des anticorps antieptinezumab avec une incidence globale d'anticorps neutralisants de 7 % (9/128). Le taux de patients présentant des anticorps anti-médicament était de 5,3 % à la semaine 48, de 4 % à la semaine 72, et tous les patients, à l'exception d'un patient perdu de vue, étaient négatifs pour les anticorps antimédicament à la semaine 104 (dernière évaluation de l'étude).
Dans les études cliniques, les concentrations plasmatiques résiduelles d'eptinezumab semblaient inférieures chez les patients ayant développé des anticorps anti-eptinezumab. Aucune preuve de l'impact du développement d'anticorps anti-eptinezumab sur l'efficacité ou la sécurité n'a été démontrée dans les études cliniques.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration - voir Annexe V.
GARDER
LE PATIENT en observation ou sous surveillance pendant et après la
perfusion conformément à la pratique clinique habituelle.
Grossesse
Il existe des données limitées sur l'utilisation de l'eptinezumab chez la femme enceinte. Les études effectuées chez l'animal avec l'eptinezumab n'ont pas mis en évidence d'effets délétères directs ou indirects sur la reproduction (voir rubrique Données de sécurité préclinique). Les IgG humaines traversent la barrière placentaire ; par conséquent, l'eptinezumab peut potentiellement être transmis de la mère au fœtus en développement.
Par mesure de précaution, il est préférable d'éviter l'utilisation de VYEPTI pendant la grossesse.
Allaitement
Il n'existe pas de données sur la présence de l'eptinezumab dans le lait maternel, sur les effets chez les nourrissons allaités ni sur les effets sur la production de lait. Les IgG humaines sont excrétées dans le lait maternel au cours des premiers jours suivant la naissance et leur concentration décroit par la suite pour atteindre des niveaux bas ; par conséquent, un risque pour les nourrissons allaités ne peut être exclu durant cette courte période. Par la suite, l'utilisation de l'eptinezumab pourrait être envisagée pendant l'allaitement, uniquement en cas de besoin clinique.
Fertilité
L'effet de l'eptinezumab sur la fertilité humaine n'a pas été évalué. Les études menées chez l'animal n'ont mis en évidence aucun impact sur la fertilité des femelles ou des mâles (voir rubrique Données de sécurité préclinique).
L'eptinezumab n'est pas métabolisé par les enzymes du cytochrome P450. Par conséquent, les interactions de l'eptinezumab avec des médicaments co-administrés qui sont substrats, inducteurs ou inhibiteurs des enzymes du cytochrome P450 sont considérées comme peu probables.
Le traitement doit être instauré par un professionnel de santé expérimenté dans le diagnostic et le traitement de la migraine. La perfusion de VYEPTI doit être mise en route et supervisée par un professionnel de santé.
Posologie
La posologie recommandée est de 100 mg en perfusion intraveineuse toutes les 12 semaines. Une posologie de 300 mg en perfusion intraveineuse toutes les 12 semaines peut bénéficier à certains patients (voir rubrique Propriétés pharmacodynamiques).
La nécessité d'augmenter la posologie doit être évaluée dans les 12 semaines suivant l'instauration du traitement. Lors du changement de posologie, la première dose du nouveau schéma doit être administrée à la date qui était prévue pour la perfusion suivante.
Le bénéfice global et l'intérêt de poursuivre le traitement doivent être évalués 6 mois après l'instauration du traitement. La décision de poursuivre le traitement doit être prise au cas par cas.
Populations particulières
Patients âgés (65 ans et plus)
Il existe peu de données sur l'utilisation de VYEPTI chez les patients âgés de 65 ans et plus. Aucune adaptation posologique n'est nécessaire chez les patients âgés, car la pharmacocinétique de l'eptinezumab n'est pas modifiée avec l'âge.
Insuffisance rénale ou hépatique
Aucune adaptation posologique n'est nécessaire chez les patients présentant une insuffisance rénale ou hépatique (voir rubrique Propriétés pharmacocinétiques).
Population pédiatrique
La sécurité et l'efficacité de VYEPTI chez les enfants âgés de 6 à 18 ans n'ont pas encore été établies. Aucune donnée n'est disponible actuellement.
Il n'existe pas d'utilisation justifiée de VYEPTI chez les enfants âgés de moins de 6 ans dans la prophylaxie de la migraine.
Mode d'administration
VYEPTI est destiné à la voie intraveineuse et ne doit être administré qu'après dilution.
Pour les instructions concernant la dilution du médicament avant administration, voir la rubrique Précautions particulières d’élimination et de manipulation.
Après dilution, perfuser VYEPTI sur une période d'environ 30 minutes.
Le professionnel de santé traitant doit garder le patient en observation ou sous surveillance pendant et après la perfusion conformément à la pratique clinique habituelle.
Ne pas injecter VYEPTI en bolus.
Durée de conservation :
3 ans.
La solution pour perfusion de VYEPTI (VYEPTI et solution injectable de chlorure de sodium à 0,9 %) doit être perfusée dans les 8 heures suivant la dilution (voir rubrique Précautions particulières d’élimination et de manipulation).
Précautions particulières de conservation :
À conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler. Ne pas agiter.
Conserver le flacon dans l'emballage extérieur à l'abri de la lumière.
Une fois sorti du réfrigérateur, VYEPTI doit être utilisé dans les 7 jours s'il est conservé dans l'emballage en carton d'origine à température ambiante (à une température ne dépassant pas 25 °C) ou être jeté. S'il est conservé à une température plus élevée ou pendant une période plus longue, il doit être jeté.
Après dilution, la solution pour perfusion de VYEPTI (VYEPTI et solution injectable de chlorure de sodium à 0,9 %) peut être conservée à température ambiante (à une température ne dépassant pas 25 °C) ou au réfrigérateur (entre 2 °C et 8 °C). Après dilution, la solution pour perfusion de VYEPTI doit être perfusée dans les 8 heures.
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments, à l'exception de ceux mentionnés dans la rubrique Précautions particulières d’élimination et de manipulation.
En clinique, des doses allant jusqu'à 1 000 mg ont été administrées par voie intraveineuse sans qu'aucun problème de tolérance ni d'effets indésirables cliniquement pertinents ne soient observés.
En cas de surdosage, le patient doit recevoir un traitement symptomatique et des mesures de soutien doivent être instaurées le cas échéant.
Classe pharmacothérapeutique : Analgésiques, antagonistes du peptide relié au gène de la calcitonine (CGRP), Code ATC : N02CD05.
Mécanisme d'action
L'eptinezumab est un anticorps recombinant humanisé de type immunoglobuline G1 (IgG1) qui se lie aux formes α et β du peptide relié au gène de la calcitonine (CGRP, calcitonin gene-related peptide) humain, avec une affinité de l'ordre du picomolaire (Kd de 4 et 3 pM, respectivement). L'eptinezumab empêche l'activation des récepteurs du CGRP et par conséquent, la cascade des événements physiologiques liés au déclenchement de la crise migraineuse.
L'eptinezumab inhibe l'inflammation neurogène et la vasodilatation induites par les deux isoformes α et β du CGRP.
L'eptinezumab est très sélectif (> 100 000 fois plus par rapport aux neuropeptides apparentés amyline, calcitonine, adrénomédulline et intermédine).
Efficacité et sécurité cliniques
VYEPTI (eptinezumab) a été évalué dans la prophylaxie de la migraine lors de deux études pivot contrôlées contre placebo : l'étude PROMISE 1 a été réalisée chez des patients atteints de migraine épisodique (n = 888) et l'étude PROMISE 2 chez des patients atteints de migraine chronique (n = 1 072). Les patients inclus avaient des antécédents de migraine (avec ou sans aura) depuis au moins 12 mois, selon les critères diagnostiques de la classification internationale des céphalées (International Classification of Headache Disorders, ICHD-II ou III).
PROMISE 1 : migraine épisodique
PROMISE 1 était une étude en double aveugle, contrôlée contre placebo, en groupes parallèles visant à évaluer l'efficacité et la sécurité de VYEPTI dans la prophylaxie de la migraine épisodique chez les adultes. Au total, 665 patients ont été randomisés pour recevoir le placebo (n = 222), 100 mg d'eptinezumab (n = 221) ou 300 mg d'eptinezumab (n = 222) toutes les 12 semaines pendant 48 semaines (4 perfusions). La migraine épisodique était définie par un nombre de jours de céphalées ≥ 4 et ≤ 14, dont au moins 4 devaient être des jours de migraine pendant chaque période de 28 jours dans les 3 mois précédant la sélection et confirmé pendant la période d'inclusion. Les patients étaient autorisés à prendre des traitements concomitants contre les crises migraineuses ou les céphalées, y compris des médicaments antimigraineux spécifiques (par exemple, triptans ou dérivés de l'ergot de seigle) pendant l'étude. L'utilisation régulière (plus de 7 jours par mois) d'autres traitements préventifs de la migraine n'était pas autorisée.
Le critère principal d'efficacité était la variation par rapport à l'inclusion du nombre moyen de jours de migraine par mois (JMM) au cours des semaines 1 à 12. Les principaux critères secondaires comprenaient les taux de patients répondeurs à ≥ 50 % et ≥ 75 %, ces taux étant définis par la proportion de patients présentant une réduction d'au moins 50 % (ou 75 %) des jours de migraine par mois au cours des semaines 1 à 12, le taux de patients répondeurs à ≥ 75 % au cours des semaines 1 à 4, et le pourcentage de patients présentant une migraine le jour suivant la première perfusion (jour 1).
L'âge moyen des patients était de 40 ans (intervalle : 18 à 71 ans), 84 % étaient des femmes et 84 % étaient caucasiens. À l'inclusion, le nombre moyen de jours de migraine par mois était de 8,6 et le taux de patients présentant une migraine à un jour donné était de 31 % ; ces deux paramètres étaient comparables entre les groupes de traitement.
Une diminution du nombre moyen de jours de migraine par mois a été observée pour les deux posologies par rapport au placebo dès le premier jour suivant l'administration.
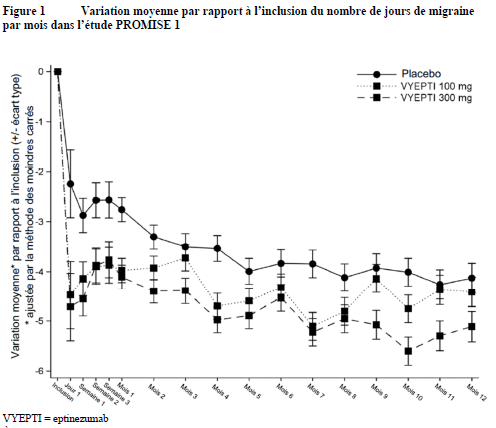
À chaque point d'évaluation, une analyse de la covariance (ANCOVA), comprenant le traitement et l'utilisation d'un traitement prophylactique comme facteurs et le nombre de jours de migraine à l'inclusion comme covariable continue, a été utilisée pour estimer la variation moyenne par rapport à l'inclusion.
Tableau 2 : Résultats obtenus pour le critère principal d'efficacité et les principaux critères d'efficacité secondaires dans l'étude PROMISE 1 (migraine épisodique)
|
VYEPTI 100 mg n = 221 |
VYEPTI 300 mg n = 222 |
Placebo n = 222 |
|
|
Nombre de jours de migraine par mois - Semaines 1 à 12 |
|||
|
Inclusion |
8,7 |
8,6 |
8,4 |
|
Variation moyenne |
-3,9 |
-4,3 |
-3,2 |
|
Différence par rapport au placebo |
-0,7 |
-1,1 |
|
|
IC95 % |
(-1,3, -0,1) |
(-1,7, -0,5) |
|
|
Valeur pvs placebo |
0,0182 |
0,0001 |
|
|
Patients répondeurs à ≥ 75 % - Semaines 1 à 4 |
|||
|
Patients répondeurs |
30,8 % |
31,5 % |
20,3 % |
|
Différence par rapport au placebo |
10,5 % |
11,3 % |
|
|
Valeur pvs placebo |
0,0112 |
0,0066 |
|
|
Patients répondeurs à ≥ 75 % - Semaines 1 à 12 |
|||
|
Patients répondeurs |
22,2 % |
29,7 % |
16,2 % |
|
Différence par rapport au placebo |
6,0 % |
13,5 % |
|
|
Valeur pvs placebo |
0,1126 |
0,0007 |
|
|
Patients répondeurs à ≥ 50 % - Semaines 1 à 12 |
|||
|
Patients répondeurs |
49,8 % |
56,3 % |
37,4 % |
|
Différence par rapport au placebo |
12,4 % |
18,9 % |
|
|
Valeur pvs placebo |
0,0085 |
0,0001 |
|
PROMISE 2 : migraine chronique
PROMISE 2 était une étude internationale, en double aveugle, contrôlée contre placebo, en groupes parallèles visant à évaluer l'efficacité et la sécurité de VYEPTI dans la prophylaxie de la migraine chronique chez les adultes. Au total, 1 072 patients ont été randomisés et ont reçu le placebo (n = 366), 100 mg d'eptinezumab (n = 356) ou 300 mg d'eptinezumab (n = 350) toutes les 12 semaines pendant 24 semaines (2 perfusions). La migraine chronique était définie par un nombre de jours de céphalées ≥ 15 et ≤ 26, dont ≥ 8 étaient évalués comme étant des jours de migraine dans les 3 mois précédant la sélection et confirmé pendant la période de sélection de 28 jours. Pendant l'étude, les patients étaient autorisés à prendre un traitement aigu ou préventif de la migraine ou des céphalées à une posologie établie et stable (à l'exception de la toxine botulinique de type A).
Un total de 431 patients (40 %) avec un double diagnostic de migraine chronique et de céphalées par abus médicamenteux (associées à la surconsommation de triptans, d'ergotamine ou d'associations d'antalgiques > 10 jours/mois, ou de paracétamol, d'acide acétylsalicylique ou d'anti-inflammatoires non stéroïdiens ≥ 15 jours/mois) confirmé pendant la période de sélection a été inclus dans la population de l'étude.
Le critère principal d'efficacité était la variation par rapport à l'inclusion du nombre moyen de jours de migraine par mois au cours des semaines 1 à 12. Les principaux critères secondaires comprenaient les taux de patients répondeurs à ≥ 50 % et ≥ 75 %, définis comme la proportion de patients présentant une réduction d'au moins 50 % (ou 75 %) des jours de migraine par mois au cours des semaines 1 à 12, le taux de patients répondeurs à ≥ 75 % au cours des semaines 1 à 4, le pourcentage de patients présentant une migraine le jour suivant la perfusion, la diminution de la prévalence des migraines entre l'inclusion et la semaine 4, la variation par rapport à l'inclusion du score total de l'échelle HIT-6 (Headache Impact Test) à la semaine 12 (uniquement pour la dose de 300 mg) et la variation moyenne par rapport à l'inclusion du nombre de jours par mois d'utilisation d'un traitement aigu de la crise migraineuse au cours des semaines 1 à 12 (uniquement pour la dose de 300 mg).
L'âge moyen des patients était de 41 ans (intervalle : 18 à 65 ans), 88 % étaient des femmes et 91 % étaient caucasiens. Quarante-et-un pourcent des patients prenaient un traitement concomitant préventif de la migraine. À l'inclusion, le nombre moyen de jours de migraine par mois était de 16,1 et le taux de patients présentant une migraine un jour donné était de 57,6 % ; ces deux paramètres étaient comparables entre les groupes de traitement.
Une diminution du nombre moyen de jours de migraine par mois a été observée pour les deux doses par rapport au placebo dès le premier jour suivant l'administration.
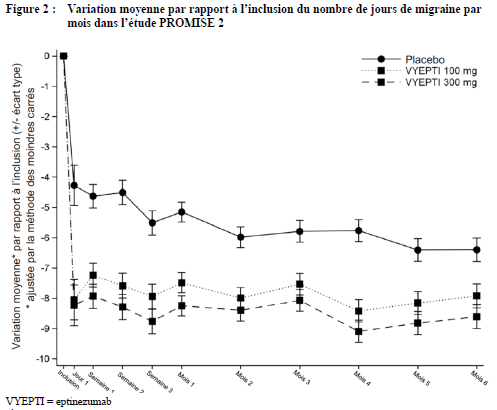
À chaque point d'évaluation, une analyse de la covariance (ANCOVA), comprenant le traitement et l'utilisation d'un traitement prophylactique comme facteurs et le nombre de jours de migraine à l'inclusion comme covariable continue, a été utilisée pour estimer la variation moyenne par rapport à l'inclusion.
Tableau 3 : Résultats obtenus pour le critère principal d'efficacité et les principaux critères d'efficacité secondaires dans l'étude PROMISE 2 (migraine chronique)
|
VYEPTI 100 mg n = 356 |
VYEPTI 300 mg n = 350 |
Placebo n = 366 |
||
|
Nombre de jours de migraine par mois - Semaines 1 à 12 |
||||
|
Inclusion |
16,1 |
16,1 |
16,2 |
|
|
Variation moyenne |
-7,7 |
-8,2 |
-5,6 |
|
|
Différence par rapport au placebo |
-2,0 |
-2,6 |
||
|
IC95 % |
(-2,9, -1,2) |
(-3,5, -1,7) |
||
|
Valeur pvs placebo |
< 0,0001 |
< 0,0001 |
||
|
Patients répondeurs à ≥ 75 % - Semaines 1 à 4 |
||||
|
Patients répondeurs |
30,9 % |
36,9 % |
15,6 % |
|
|
Différence par rapport au placebo |
15,3 % |
21,3 % |
||
|
Valeur pvs placebo |
< 0,0001 |
< 0,0001 |
||
|
Patients répondeurs à ≥ 75 % - Semaines 1 à 12 |
||||
|
Patients répondeurs |
26,7 % |
33,1 % |
15,0 % |
|
|
Différence par rapport au placebo |
11,7 % |
18,1 % |
||
|
Valeur pvs placebo |
0,0001 |
< 0,0001 |
||
|
Patients répondeurs à ≥ 50 % - Semaines 1 à 12 |
||||
|
Patients répondeurs |
57,6 % |
61,4 % |
39,3 % |
|
|
Différence par rapport au placebo |
18,2 % |
22,1 % |
||
|
Valeur pvs placebo |
< 0,0001 |
< 0,0001 |
||
|
Score HIT-6 - Semaine 12a |
||||
|
Inclusion |
65,0 |
65,1 |
64,8 |
|
|
Variation moyenne |
-6,2 |
-7,3 |
||
|
Différence par rapport au placebo |
-1,7 |
-2,9 |
-4.5 |
|
|
IC95 % |
(-2,8, -0,7) |
(-3,9, -1,8) |
||
|
Valeur pvs placebo |
0,0010 |
< 0,0001 |
||
|
Jours par mois avec utilisation d'un traitement aigu - Semaines 1 à 12a,b |
||||
|
Inclusion |
6,6 |
6,7 |
6,2 |
|
|
Variation moyenne |
-3,3 |
-3,5 |
||
|
Différence par rapport au placebo |
-1,2 |
-1,4 |
-1,9 |
|
|
IC95 % |
(-1,7, -0,7) |
(-1,9, -0,9) |
||
|
Valeur pvs placebo |
< 0,0001 |
< 0,0001 |
||
a Le critère de jugement pour la dose de 100 mg n'était pas un critère de jugement secondaire prédéfini.
b La valeur à l'inclusion était la moyenne sur la période de sélection de 28 jours avant l'administration du traitement.
Patients avec un diagnostic de céphalées par abus médicamenteux
Chez les 431 patients (40 %) diagnostiqués avec des céphalées par abus médicamenteux dans l'étude PROMISE 2, la variation moyenne par rapport à l'inclusion des jours de migraine par mois (semaines 1 à 12) était de -8,4 jours pour VYEPTI 100 mg, de -8,6 jours pour VYEPTI 300 mg et de -5,4 jours pour le placebo (différence moyenne par rapport au placebo de -3,0 jours et de -3,2 jours, respectivement pour les doses de 100 mg et 300 mg).
DELIVER : échecs aux traitements préventifs antérieurs de la migraine
VYEPTI a été évalué lors d'une étude d'efficacité et de sécurité (DELIVER) chez des patients atteints de migraine épisodique (n = 484) et chronique (n = 405) et en échec documenté à deux à quatre classes de traitement préventif antérieur de la migraine, qui comportait une période de traitement contrôlée contre placebo, en double aveugle, de 24 semaines et une période d'extension à long terme de 48 semaines.
L'étude a montré que le traitement par VYEPTI a entraîné une réduction moyenne du nombre de jours de migraine par mois (JMM) au cours des semaines 1 à 12 : -4,8 jours pour le groupe recevant VYEPTI à la dose de 100 mg et -5,3 jours pour le groupe recevant VYEPTI à la dose de 300 mg, par rapport à -2,1 jours dans le groupe sous placebo, ce qui correspond à une différence par rapport au placebo de -2,7 jours (IC à 95 % : -3,4 à -2,0) et de -3,2 jours (IC à 95 % : -3,9 à -2,5), respectivement.
L'étude a également montré qu'une réduction ≥ 50 % du nombre de jours de migraine par mois au cours des semaines 1 à 12 a été obtenue chez 42 % des patients du groupe recevant VYEPTI à la dose de 100 mg et chez 50 % des patients du groupe recevant VYEPTI à la dose de 300 mg, par rapport à 13 % des patients du groupe sous placebo. Une réduction ≥ 75 % du nombre de jours de migraine par mois au cours des semaines 1 à 12 a été obtenue chez 16 % des patients du groupe recevant VYEPTI à la dose de 100 mg et chez 19 % des patients du groupe recevant VYEPTI à la dose de 300 mg, par rapport à 2 % des patients du groupe sous placebo.
L'efficacité démontrée pendant la période de traitement contrôlée contre placebo a été maintenue pendant un maximum de 72 semaines de traitement par VYEPTI lors de la période d'extension.
Les données de sécurité concordaient avec le profil de sécurité de VYEPTI décrit à la rubrique Effets indésirables.
RELIEF : instauration d'un traitement préventif pendant une crise migraineuse
VYEPTI a été évalué lors d'une étude d'efficacité et de sécurité (RELIEF) chez des patients ayant 4 à 15 jours de migraine par mois (n = 480). Les patients ont reçu VYEPTI ou un placebo dans les 1 à 6 heures suivant l'apparition d'une crise migraineuse modérée à sévère.
L'étude indique que, lorsqu'il est instauré durant une crise migraineuse modérée à sévère, le traitement par VYEPTI entraîne une réduction statistiquement significative du délai jusqu'à disparition des céphalées (p < 0,001 ; délai médian de 4 heures contre 9 heures) ainsi que du délai jusqu'à résolution des symptômes pour les symptômes les plus gênants (p < 0,001 ; délai médian de 2 heures contre 3 heures) par rapport au placebo chez les patients éligibles à un traitement préventif de la migraine. Un plus grand nombre de patients migraineux traités par VYEPTI ont également présenté une disparition des céphalées (24 % contre 12 %) ainsi qu'une absence des symptômes les plus gênants (56 % contre 36 %) au bout de deux heures par rapport au placebo (p < 0,001), et un nombre moins important de patients a nécessité un traitement de secours après avoir été traités par VYEPTI par rapport au placebo (p < 0,001) dans les 24 premières heures après la perfusion.
Les données de sécurité concordaient avec le profil de sécurité de VYEPTI décrit à la rubrique Effets indésirables.
PREVAIL : étude à long terme
VYEPTI à la dose de 300 mg a été administré toutes les 12 semaines par perfusion intraveineuse pendant une période allant jusqu'à 96 semaines chez 128 patients souffrant de migraine chronique.
L'objectif principal était l'évaluation de la sécurité à long terme après administrations répétées de VYEPTI. Les objectifs secondaires comprenaient la caractérisation du profil pharmacocinétique et du profil d'immunogénicité de VYEPTI (rubrique Effets indésirables) et l'évaluation de l'effet thérapeutique de VYEPTI sur plusieurs critères rapportés par le patient relatifs à la migraine et à la qualité de vie, avec notamment l'échelle HIT-6 (Headache Impact Test). L'âge moyen des patients était de 41,5 ans (intervalle : 18 à 65 ans), 85 % étaient des femmes, 95 % étaient caucasiens et 36 % prenaient un traitement concomitant préventif de la migraine. Le nombre moyen de jours de migraine par période de 28 jours dans les 3 mois précédant la sélection était de 14,1 jours. Au total, 100 patients (78,1 %) ont terminé l'étude (semaine 104). À l'inclusion, les patients étaient lourdement impactés, avec un score HIT-6 total moyen de 65. La variation moyenne par rapport à l'inclusion jusqu'à la semaine 104 était de -9,7 (p < 0,0001). Le profil de sécurité concordait avec les profils de sécurité observés dans les études randomisées contrôlées contre placebo et un effet prolongé sur les critères pertinents pour le patient a été observé pendant une période allant jusqu'à 96 semaines.
Population pédiatrique
L'Agence européenne des médicaments a différé l'obligation de soumettre les résultats d'études réalisées avec VYEPTI dans un ou plusieurs sous-groupes de la population pédiatrique dans la prophylaxie de la migraine (voir rubrique Posologie et mode d'administration pour les informations concernant l'usage pédiatrique).
VYEPTI étant administré par voie intraveineuse, sa biodisponibilité est de 100 %. L'eptinezumab présente une pharmacocinétique linéaire et l'exposition augmente proportionnellement à la dose pour des doses comprises entre 10 et 1 000 mg. À la posologie d'une administration toutes les 12 semaines, l'état d'équilibre est atteint après la première dose. Le temps médian pour atteindre la concentration maximale (Cmax) est de 30 minutes (fin de la perfusion) et la demi-vie d'élimination moyenne est de 27 jours. Les taux d'accumulation moyens estimés par la Cmax et l'ASC0-tau sont de 1,08 et 1,15, respectivement.
Absorption
VYEPTI est administré par perfusion intraveineuse ce qui évite l'absorption extravasculaire. Sa biodisponibilité est de 100 %. La concentration maximale était atteinte à la fin de la perfusion, soit avec un temps médian de 30 minutes.
Distribution
Le volume de distribution central (Vc) de l'eptinezumab était d'environ 3,7 litres.
Biotransformation
Il est attendu que l'eptinezumab soit dégradé en petits peptides et en acides aminés par les enzymes protéolytiques.
Élimination
La clairance apparente de l'eptinezumab était de 0,15 L/jour et sa demi-vie d'élimination d'environ 27 jours.
Populations particulières
L'effet de l'âge, du sexe, de l'origine ethnique et du poids sur la pharmacocinétique de l'eptinezumab a été étudié dans le cadre d'une analyse pharmacocinétique de population ayant porté sur 2 123 sujets. Par rapport à un sujet de 70 kg, l'exposition à l'eptinezumab à l'état d'équilibre chez un sujet pesant 190 kg était jusqu'à 52 % plus faible, tandis qu'elle serait jusqu'à 50 % plus élevée chez un sujet pesant 39 kg. Cependant, l'évaluation de la relation exposition-réponse n'a pas mis en évidence d'effet du poids sur l'efficacité clinique. Aucune adaptation posologique n'est nécessaire en fonction du poids. La pharmacocinétique de population a montré que la pharmacocinétique de l'eptinezumab n'est pas modifiée avec l'âge (18 à 71 ans), le sexe ou l'origine ethnique. Par conséquent, aucune adaptation posologique n'est nécessaire.
Insuffisance rénale ou hépatique
Aucune étude spécifique n'a été menée pour évaluer les effets de l'insuffisance hépatique ou rénale sur la pharmacocinétique de l'eptinezumab. L'analyse pharmacocinétique de population des données combinées des études cliniques portant sur VYEPTI n'a mis en évidence aucune différence qui justifierait une adaptation de la posologie chez les patients présentant une insuffisance rénale ou hépatique. Aucune donnée n'est disponible pour les patients présentant une insuffisance rénale sévère.
VYEPTI n'a aucun effet ou un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines.
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, de toxicité en administration répétée, de toxicité animale juvénile ou des fonctions de reproduction et de développement, n'ont pas révélé de risque particulier pour l'Homme.
Génotoxicité et cancérogenèse
Dans la mesure où il est peu probable que l'eptinezumab interagisse directement avec l'ADN ou tout autre matériel chromosomique, les évaluations de la génotoxicité potentielle ont été jugées non nécessaires et n'ont pas été réalisées.
Aucun risque de cancérogenèse n'ayant été identifié suite à l'évaluation approfondie de la littérature relative à l'inhibition du CGRP, et aucun cas de prolifération n'ayant été associé à l'eptinezumab lors des études à long terme menées chez le singe, les études de cancérogenèse ont été jugées non nécessaires et n'ont pas été réalisées.
Ce médicament doit être dilué avant d'être administré. La dilution doit être préparée par un professionnel de santé dans le respect des règles d'asepsie afin que la stérilité de la solution préparée soit garantie en vue de la perfusion.
Le médicament ne contient pas de conservateur et est destiné à une administration unique, tout médicament non utilisé devant être éliminé.
Avant dilution, le médicament (solution à diluer dans les flacons) doit être inspecté visuellement ; ne pas utiliser si la solution à diluer contient des particules visibles, si elle est trouble ou si elle présente une coloration anormale (autre que limpide à légèrement opalescente, incolore à jaune brunâtre).
Que ce soit pour la dose de 100 mg ou celle de 300 mg, une poche de 100 mL de solution injectable de chlorure de sodium à 9 mg/mL (0,9 %) doit être utilisée pour préparer la solution pour perfusion de VYEPTI comme cela est décrit ci-après. Aucune autre solution pour perfusion ou volume ne peut être utilisé pour préparer la solution pour perfusion de VYEPTI.
Retourner délicatement la solution pour perfusion de VYEPTI pour bien la mélanger. Ne pas agiter.
La solution pour perfusion de VYEPTI doit être perfusée dans les 8 heures suivant la dilution. Pendant cet intervalle, la solution pour perfusion de VYEPTI peut être conservée à température ambiante (à une température ne dépassant pas 25 °C) ou au réfrigérateur (entre 2 °C et 8 °C). Si la solution pour perfusion de VYEPTI est conservée entre 2 °C et 8 °C, la laisser revenir à température ambiante avant de la perfuser. NE PAS CONGELER.
Dose de 100 mg de VYEPTI
Pour préparer la solution pour perfusion de VYEPTI, prélever 1,0 mL de VYEPTI dans un flacon monodose de 100 mg à l'aide d'une seringue et d'une aiguille stériles. Injecter le volume de 1,0 mL (100 mg) dans une poche de 100 mL de solution injectable de chlorure de sodium à 0,9 %.
Dose de 300 mg de VYEPTI
Pour préparer la solution pour perfusion de VYEPTI, prélever 1,0 mL de VYEPTI dans trois flacons monodose de 100 mg ou 3,0 mL de VYEPTI dans un flacon monodose de 300 mg à l'aide d'une seringue et d'une aiguille stériles. Injecter le volume de 3,0 mL (300 mg) obtenu dans une poche de 100 mL de solution injectable de chlorure de sodium à 0,9 %.
Instructions pour la perfusion
Les médicaments destinés à la voie parentérale doivent être inspectés visuellement avant administration afin de permettre la détection éventuelle de particules ou d'une coloration anormale. Ne pas utiliser si le liquide contient des particules visibles, s'il est trouble ou s'il présente une coloration anormale.
Perfuser VYEPTI à la dose de 100 mg ou de 300 mg conformément à la prescription, après dilution du contenu du ou des flacons dans une poche de 100 mL de solution injectable de chlorure de sodium à 0,9 %, pendant environ 30 minutes. Utiliser une tubulure de perfusion intraveineuse munie d'un filtre en ligne de 0,2 ou 0,22 μm ou à laquelle un filtre a été ajouté. Lorsque tout le liquide a été perfusé, rincer la tubulure de perfusion à l'aide de 20 mL de solution injectable de chlorure de sodium à 0,9 %.
Ne pas injecter VYEPTI en bolus.
Aucun autre médicament ne doit être administré dans la tubulure de perfusion ni mélangé à VYEPTI.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Liste I.
Prescription réservée aux spécialistes et services
NEUROLOGIE.
Réservé à l'usage HOSPITALIER.
Solution à diluer pour perfusion (solution à diluer stérile).
La solution à diluer pour perfusion est limpide à légèrement opalescente, incolore à jaune brunâtre avec un pH compris entre 5,5 et 6,1 et une osmolalité comprise entre 290 et 350 mOsm/kg.
Flacon en verre de type I de 4 mL avec bouchon en caoutchouc chlorobutyle. Le bouchon du flacon ne contient pas de latex naturel.
VYEPTI est disponible en boîte de 1 flacon à usage unique.
VYEPTI 100 mg solution à diluer pour perfusion
Chaque flacon de solution à diluer contient 100 mg d'eptinezumab par mL.
L'eptinezumab est un anticorps monoclonal humanisé produit dans des cellules de levure Pichia pastoris.
Excipient(s) à effet notoire :
Ce médicament contient 40,5 mg de sorbitol par mL et 0,15 mg de polysorbate 80 par mL.
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Sorbitol (E420)
L-histidine
Chlorhydrate de L-histidine monohydraté
Polysorbate 80
Eau pour préparations injectables
